整合幹細胞中心 | 引領卓越
引領卓越
當代頂尖學術研究的重大突破,有賴於跨領域的廣闊視野與深度合作。〈整合幹細胞中心〉已遴聘多位優秀幹細胞研究人員、與跨領域優秀專家學者,共同組成國際級基礎研究團隊,並與中國醫藥大學體系既有幹細胞轉譯與臨床研究緊密結合,成立至今已發表多項卓越研究成果,並建立完成重大基礎研究設施-中台灣首座雙光子顯微影像核心系統。
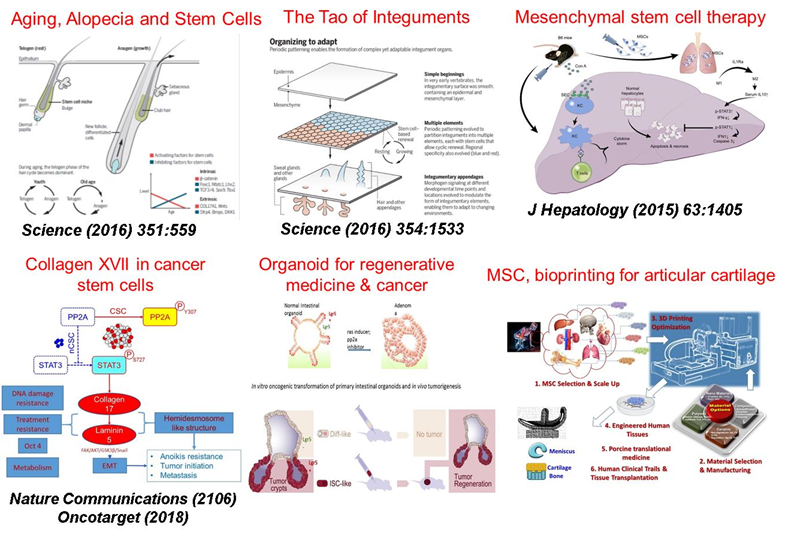
圖一:本中心近期重大研究成果與研究主軸
本中心領導跨領域團隊解密鳥羽功能性結構的再生與演化
皮膚及附屬物具高速再生與多功能特性,是再生醫學與幹細胞研究的重要研究課題。本中心阮文滔副研究員與美國南加大鍾正明教授所共同領導的跨領域研究團隊,結合了生物物理、分子發育和考古研究,以自然界最複雜的皮膚附屬鳥羽為對象,探討羽毛的結構組成、再生演化與功能機制之謎。我們的成果,解密了生命如何因應生態環境適應的需求,並在自然定律的限制下,從簡單組織發育成適應生態需求的複雜多功能結構的法則。我們的研究,也將啟發未來再生醫學新策略,並促進新穎仿生複合材料的開發。
 由本中心阮文滔副研究員及南加大鍾正明教授所領導的國際跨領域團隊,在鳥羽再生與仿生材料開發的開創性突破,刊登於2019年11月27日出刊的國際頂尖學術雜誌Cell,並獲出版商選為該期雜誌的封面故事,將台灣國鳥藍鵲的展翼英姿與中醫大的研究能量,推升至頂尖國際學術舞台。此論文31位作者中,共有23位台灣本土作者,其中有10位來自中醫大體系。
由本中心阮文滔副研究員及南加大鍾正明教授所領導的國際跨領域團隊,在鳥羽再生與仿生材料開發的開創性突破,刊登於2019年11月27日出刊的國際頂尖學術雜誌Cell,並獲出版商選為該期雜誌的封面故事,將台灣國鳥藍鵲的展翼英姿與中醫大的研究能量,推升至頂尖國際學術舞台。此論文31位作者中,共有23位台灣本土作者,其中有10位來自中醫大體系。
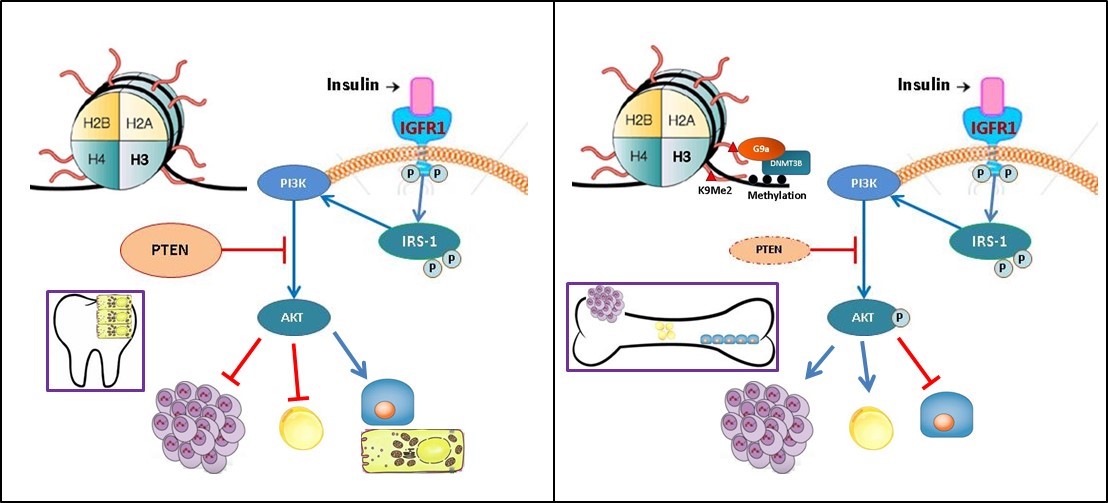 你知道牙齒比骨頭硬嗎?而且牙齒內有腫瘤是非常罕見的嗎?有趣的是,正如洪士杰主任發表於「自然通訊」雜誌論文所報告的那樣,這兩種現象具有相似的潛在機制。研究證明源自牙髓的幹細胞具有減少的DNA甲基化和組蛋白修飾以及更高的PTEN活化,從而促使它們的命運成為體內最硬的組織並降低它們的腫瘤發生的可能性。
你知道牙齒比骨頭硬嗎?而且牙齒內有腫瘤是非常罕見的嗎?有趣的是,正如洪士杰主任發表於「自然通訊」雜誌論文所報告的那樣,這兩種現象具有相似的潛在機制。研究證明源自牙髓的幹細胞具有減少的DNA甲基化和組蛋白修飾以及更高的PTEN活化,從而促使它們的命運成為體內最硬的組織並降低它們的腫瘤發生的可能性。
我們最近發表於Nature Communications, 10: 2226, 2019的論文證明源自牙髓的幹細胞具有減少的DNA甲基化和組蛋白修飾以及更高的PTEN活化,從而促使它們的命運成為體內最硬的組織並降低它們腫瘤發生的可能性。雖然分化潛能和腫瘤發生等特徵可以用以區分幹細胞。但過去文獻未針對源自人牙髓(DP-MSCs)和骨髓的間葉幹細胞(BM-MSCs)進行充分的定性分析及比較。此論文發現DP-MSCs表現出增加的成骨分化潛能,但具有降低的脂肪分化潛力,並可以形成牙本質牙髓樣複合物,並且與BM-MSC相比具有抗致癌轉化的能力。進一步以全基因組RNA-seq進行差異表達分析,發現兩者在脂肪細胞和成骨細胞分化,骨髓腫瘤和PTEN / PI3K / AKT等訊息途徑上,有明顯的差異。和BM-MSC相比,DP-MSC有更高的PTEN表達,是造成兩種細胞分化潛能和腫瘤發生差異的原因;且DP-MSC的PTEN啟動子上,表現出更高的DNA甲基化和更多抑制標記H3K9Me2。DNA甲基化和抑制標記H3K9Me2的增多,分別由DNMT3B和G9a等表觀遺傳因子所調控。本研究顯示表觀遺傳因子如何廣泛地調控分化潛能和腫瘤發生,未來在開發幹細胞作為治療用途時,應該考慮這些因素。
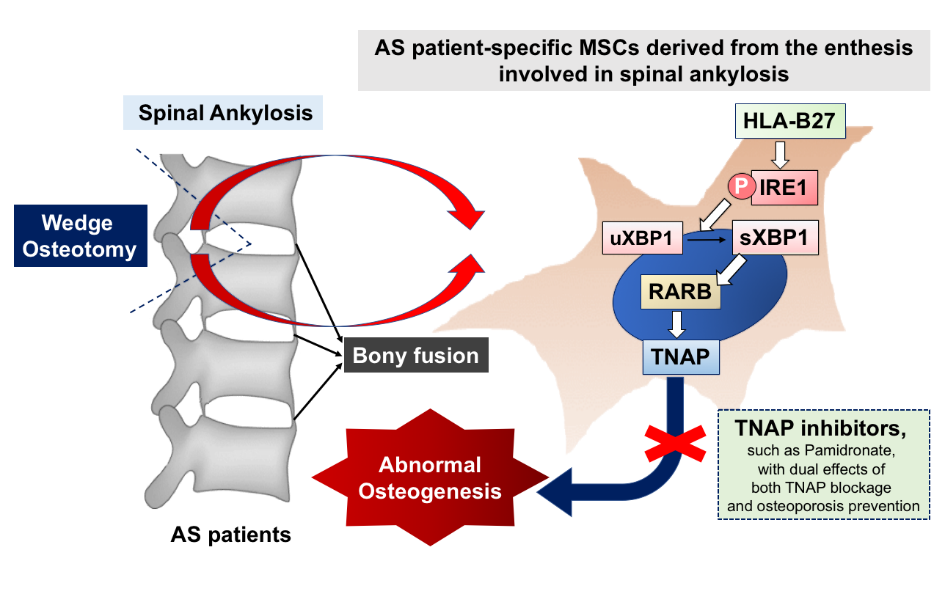 此研究強調HLA-B27介導的sXBP1-RARB-TNAP軸在AS syndesmophyte發病機制中的激活的重要性,並為診斷和預防AS的放射學進展提供了新的策略。
此研究強調HLA-B27介導的sXBP1-RARB-TNAP軸在AS syndesmophyte發病機制中的激活的重要性,並為診斷和預防AS的放射學進展提供了新的策略。
僵直性脊椎炎(AS)是一種軸向炎症。隨著時間的推移,一些患者出現脊柱關節強硬,形成bamboo spine等骨關節變形,進而造成永久性殘疾;然而,目前的治療策略不能完全阻止syndesmophyte形成。我們團隊發表在Journal of Clinical Investigation, 129(12):5357-5373 2019之論文,對AS形成syndesmophyte的機轉,提出嶄新的說明,並藉此發展新的治療方法。我們自AS患者發生脊柱強直的enthesis組織附近分離出間質幹細胞(AS MSCs),並藉此解明了 HLA-B27介導的sXBP1- RARB- TNAP訊息途徑加速了AS MSCs的礦化,這與Runx2無關。通過將AS MSC植入NOD-SCID小鼠的腰椎中來建立模擬AS病理性bony apposition的動物模型。團隊證明TNAP抑製劑,包括levamisole 和pamidronate,在體外可抑制AS MSCs礦化,並在體內阻斷bony apposition。此外,並證明血清骨特異性TNAP(BAP)濃度是預測具有高放射學進展風險的AS患者的潛在預後生物標誌物。此研究強調HLA-B27介導的sXBP1-RARB-TNAP軸在AS syndesmophyte發病機制中的激活的重要性,並為診斷和預防AS的放射學進展提供了新的策略。除了發表論文外,也已經申請專利,將來可以發展嶄新的診斷,治療和預防AS形成syndesmophyte及骨關節變形的新方法。此論文也被Nature Reviews Rheumatology所highlighted.
於創傷癒合基礎研究方面,本中心鐘正明院士所領導的研究團隊,發現Msx2基因對於皮膚的創傷癒合和毛囊再生具有十分重要的作用。當Msx2基因被剔除之後,小鼠皮膚在經受大面積(>1cm2)的創傷之後,其愈合速度明顯減慢,且癒合部位的毛囊幾乎不能再生。此研究證明瞭Msx2基因對於保持皮膚的再生能力作用之重要性,並為將來皮膚創傷癒合和附屬器官再生提供一個新的基因靶點。(J.Invest. Dermatol., Mar. 22,2018)
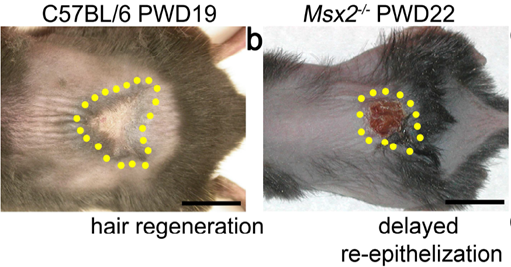
圖二: Msx2基因被剔除的小鼠,在遭受大的創傷後,其創傷癒合能力明顯減弱,且喪失毛囊等附屬器官之再生能力。
於皮膚再生策略基礎研究方面,本中心近期於祖細胞或幹細胞如何通過自組織(self-organization)形成類器官,獲得重大成就。本中心榮譽主任鐘正明院士所領導的研究團隊,結合跨領域國際研究團隊,發現細胞可通過六個階段自組織形成毛囊,不僅找到細胞自組織形成毛囊的分子學機制,並成功誘導原本失去再生能力的成體細胞重新再生出毛髮。此研究為脫髮及禿頭患者提供刺激頭髮生長的新策略。(PNAS, Aug. 7,2017)

圖三:皮膚祖細胞在體外三維培養時,可自組織形成平面皮膚的類器官(organoid)結構,在移植裸鼠后,可再生出皮膚和大量的毛囊。
在癌症方面,洪士杰主任研究團隊以多種癌症,包括大腸癌、肺癌、乳癌及腦瘤的癌症幹細胞做研究,發現癌症幹細胞的新特性,可以增加在懸浮條件下存活的能力。研究團隊從肺癌合併轉移的病人之肺積水及大腸癌合併轉移的病人之腹水中可以分離癌症幹細胞,且研究進一步發現,存在於肺積水及腹水中之癌症幹細胞相對於一般癌症細胞增加懸浮存活之能力,因此可以存活於肺積水及腹水之懸浮條件中。研究更證明癌症幹細胞懸浮存活之特性可以影響其腫瘤起始及轉移特性。研究團隊更發現透過PP2A-STAT3-Collagen XVII訊息途徑可以穩定Laminin V蛋白,這部分結果已經在今年發表於2016年Nature Communications雜誌中。

圖四:球體培養癌細胞增強腫瘤起始細胞的特徵。 (a)CCS和HT29在球體培養下形成球體的。(b)球形培養的CCS癌細胞每15傳代培養天為一代。量化CCS球的數量為三代。 (c)西方點墨法和(d)流式細胞儀分析用於散裝癌細胞和球狀體培養富集TIC的細胞計數分析。(e)對大塊癌細胞(球狀體)的Cdx2進行免疫染色富含培養基的TIC和TIC在基質膠中對陽性細胞的定量的分化觀察。(f)來源於CCS和HT29細胞的大量癌細胞和富含球形的TIC的致瘤性分析比較。
洪士杰主任研究團隊也發現癌症幹細胞特有的Collagen XVII/Laminin V訊息途徑,可以活化FAK/AKT/GSK3beta訊息途徑,進而穩定Snail蛋白,最後造成上皮間質轉化來促進遠端轉移之能力,此論文在近期網路發表於Oncotarget。目前,研究團隊利用Collagen XVII抗體,來尋找血流中的癌症幹細胞,未來並針對此研發可以毒殺血流中癌症幹細胞的藥物。綜合上述成果,發現癌症幹細胞的新特性,而且Collagen XVII可以做為多種癌症幹細胞的標記,且未來針對Collagen XVII相關的上下流途徑發展新藥物做阻斷,可以毒殺腫瘤幹細胞,進而發展新穎治療癌症的方法及策略。
在再生醫學方面,洪士杰主任研究團隊利用「低氧製程」來培養、增殖及移植間葉幹細胞。與此相關的基礎及轉譯研究,目前已經發表了20多篇論文於SCI雜誌,其中包括Molecular Cell、Blood、Stem Cell Reports及Stem Cells等國際知名期刊。
目前,洪士杰主任研究團隊正積極開展轉譯研究,將相關專利技術應用於臨床治療上,已陸續經完成了各種適應症之臨床前動物試驗,包括利用低氧間葉幹細胞治療下肢缺血、冠狀動脈狹窄、猛爆型肝炎及移植物抗宿主疾病;並用來促進骨折癒合、退化性關節炎及阿基里氏腱的修復,同時獲得衛福部核准進行以異體低氧間葉幹細胞治療下肢缺血之第一期臨床試驗。
2020:榮獲永信李天德醫藥基金會「第16屆卓越醫藥科技獎」。
2015:中華民國生物產業發展協會年度創新獎
2015:臺北生技獎-技轉合作獎之優勝
2012, 2016: 國科會/科技部 傑出研究獎
